Le molecole cariche non formano uno strato limite tra acqua salata e aria come si pensava in precedenza. Uno strato di arricchimento ionico rivela una nuova prospettiva sui confini tra i due elementi.
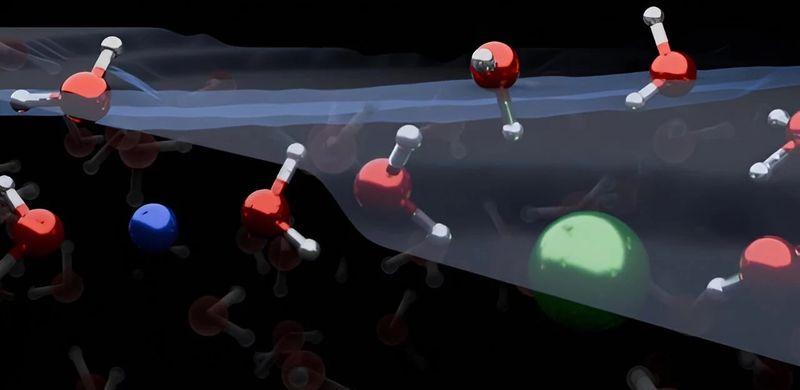
Le molecole cariche non formano uno strato limite tra acqua salata e aria come si pensava in precedenza, rivela una nuova ricerca. In effetti, sono depauperate rispetto alla loro abbondanza nel liquido nel suo complesso. Invece, a una profondità di pochi diametri di molecole si nasconde uno strato di arricchimento ionico, come una bestia mitica in agguato per sorprendere. La scoperta ribalta le percezioni di questi confini che erano considerati così sicuri da essere stati inseriti nei libri di testo scientifici.
La vita è più abbondante dove la terra incontra l’acqua e il mare incontra il cielo. Comprendere ciò che accade in questi punti di contatto è fondamentale. Tuttavia, quando si passa al mondo delle dimensioni molto piccole, studiando i confini più sottili tra questi domini, la nostra conoscenza è scarsa, il che porta gli scienziati a inventare storie basate su ciò che si aspettavano di trovare. Con l’avanzare della tecnologia, la nostra capacità di esplorare queste terre di confine, alcune delle storie si sono rivelate errate.
L’acqua salata produce particelle cariche. Se il sale è il familiare cloruro di sodio, queste saranno principalmente Na+ e Cl-, ma altri sali produrranno cationi carichi positivamente e anioni carichi negativamente diversi. Studi precedenti hanno riportato che ioni più grandi sono attivi in superficie. Si pensava in particolare che gli ioni facilmente polarizzabili, come gli anioni bromo e iodio, si accumulassero in superficie. Ciò ha portato alla conclusione che formano uno strato limite doppio lì, con i due insiemi di cariche che si annullano e orientano gli atomi d’acqua vicini in una direzione particolare.
“Il nostro lavoro dimostra che la superficie delle soluzioni elettrolitiche semplici ha una distribuzione ionica diversa da quanto si pensava in precedenza e che lo strato sottosuperficiale arricchito di ioni determina come è organizzata l’interfaccia: passando dall’aria alla soluzione salina, si incontrano prima alcuni strati di acqua pura, poi viene uno strato arricchito di ioni, prima di raggiungere il volume”, ha dichiarato il dottor Yair Litman, del Max Planck Institute for Polymer Research e dell’Università di Cambridge, in una dichiarazione.
Oltre ad avere strati di acqua sopra di loro, Litman e colleghi hanno scoperto che gli ioni sfidano le aspettative orientando le molecole d’acqua sia verso che lontano dalla superficie, anziché puntarle tutte nella stessa direzione.
L’errore di lunga data è stato causato dal fatto che gli studi sulle molecole al confine sono stati effettuati utilizzando laser per misurare le vibrazioni delle molecole in superficie, un metodo noto come generazione di somma di frequenza vibrazionale (VSFG). Questo rivelava cambiamenti nell’intensità delle vibrazioni a specifiche lunghezze d’onda quando il sale veniva aggiunto all’acqua, il che si pensava indicasse un accumulo di ioni lì.
Anche se la VSFG è efficace nel misurare l’intensità delle vibrazioni, non può rilevarne l’orientamento, in particolare se gli atomi di idrogeno nelle molecole d’acqua puntano verso l’alto o verso il basso.
Utilizzando una versione più avanzata, nota come VSFG rilevata eterodina, il team ha esaminato gli strati limite in 11 tipi di soluzioni elettrolitiche a diverse concentrazioni e ha creato modelli informatici per comprendere ciò che hanno osservato.
Tuttavia, i vecchi modelli non erano del tutto sbagliati. Due elettroliti comuni, HCl e NaClO4, si sono effettivamente radunati in superficie.
Il co-autore Professor Mischa Bonn ha dichiarato: “Questi tipi di interfacce si verificano ovunque sul pianeta, quindi studiarle non solo aiuta la nostra comprensione fondamentale, ma può anche portare a dispositivi e tecnologie migliori. Stiamo applicando questi stessi metodi per studiare le interfacce solido/liquido, che potrebbero avere potenziali applicazioni nelle batterie e nell’accumulo di energia”.
Lo studio è pubblicato in accesso aperto su Nature Chemistry.


















